6月12日,我校华西医院魏霞蔚研究员团队联合华西口腔医院邵彬副研究员在PNAS杂志发表研究论文“Inhibition of NLRP3 Inflammasome Activation by A20 through Modulation of NEK7”,揭示A20调控NLRP3炎症小体新机制。
我校华西医院为第一完成单位,我校华西医院余佳耘副教授、华西口腔医院博士生李函文、硕士生吴永杳为本文共同第一作者,魏霞蔚研究员、邵彬副研究员为共同通讯作者。该研究得到国家自然科学基金委等经费支持。

NLRP3炎症小体是先天性免疫的重要组成部分,在宿主抵御感染和调控无菌性炎症等免疫反应中起重要作用。其过度活化与多种人类炎症性疾病密切相关,包括脓毒血症、炎症性肠炎、糖尿病和牙周炎等。因此,深入了解NLRP3炎症小体的调控机制对炎症性疾病预防、药物靶点发现具有重要指导意义。
既往研究显示,A20缺失的巨噬细胞中NLRP3炎症小体自发激活,而AIM2和NLRC4等炎症小体不受影响。其可能的机制是A20通过NF-κB负调控NLRP3和pro-IL-1β的转录,抑制NLRP3炎症小体的启动;通过阻断pro-IL-1β的K-63泛素化,抑制NLRP3炎症小体的自发激活。然而上述机制似乎不能合理解释A20抑制NLRP3炎症小体的特异性。A20可能通过其他未知机制特异性抑制NLRP3炎症小体活化。
NIMA相关蛋白激酶7(NEK7)是NLRP3炎症小体激活的关键分子,它与NLRP3直接结合,调控NLRP3的寡聚化及后续炎症小体组装。研究者发现A20缺失的原代巨噬细胞(A20myel-KO BMDM)和巨噬细胞系(A20KO iBMDM)中NEK7的转录水平和蛋白水平均增加,后续实验证明NEK7的转录增加与NF-κB信号通路激活有关。随后经一系列实验发现,A20能够直接与NEK7结合,并且通过泛素化作用,促进NEK7的降解。
研究者进一步发现,A20能够显著抑制NEK7与NLRP3的结合。在这个过程中,A20的OTU结构域以及ZnF4协同ZnF7结构域发挥关键作用。随后研究者根据A20的OTU结构域特点,设计出了靶向NEK7的多肽,经表面等离子体共振(SPR)检测发现,这些多肽与NEK7具有优良的结合能力,并能够显著抑制NLRP3炎症小体的活化。最后研究者通过单细胞数据分析发现NEK7的表达与脓毒血症的进展相关,并且巨噬细胞中缺失NEK7的条件敲除小鼠(NEK7myel-KO)或者经靶向NEK7多肽治疗的小鼠对LPS的冲击具有更好的耐受性,提示NEK7是脓毒血症潜在的治疗靶点。
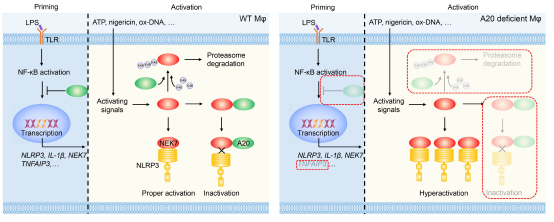
该研究从A20抑制NEK7的基因转录、介导NEK7的K-48泛素化以及抑制NEK7与NLRP3结合三个层面综合阐述了A20调控NLRP3炎症小体活化的新机制,为开发脓毒血症等炎症性疾病的靶向治疗提供了思路。
论文链接:https://www.pnas.org/doi/10.1073/pnas.2316551121

