近日,我校国家卫健委移植工程与移植免疫重点实验室刘敬平研究员团队在Science Advances发表了题为“Nutrient availability regulates the secretion and function of immune cell–derived extracellular vesicles through metabolic rewiring”的研究论文(doi: 10.1126/sciadv.adj1290.)。该研究首次报道了通过调控细胞营养代谢同时提高细胞外囊泡(Extracellularvesicle,EV)的产量和生物活性的新策略,揭示了在生产治疗性EV时应优化供体细胞的代谢状态,从而高效产生具有高生物活性的EV,增强其疾病治疗潜能。

基于细胞外囊泡(EV)的免疫疗法已在多种疾病的治疗中显示出一定应用前景。然而,现有基于细胞培养产生EV的方法面临产量较低、生物活性不足等问题,阻碍了EV疗法的未来临床转化应用。因此,探索调控免疫细胞中EV产生和活性的新型机制,有助于开发提高EV产量及其生物活性的新策略。该研究通过调整免疫细胞(巨噬细胞,Mφs)培养条件中的营养组分,包括葡萄糖、氨基酸和脂肪酸等,发现其能不同程度地影响巨噬细胞来源EV(Mφ-EV)的产量。作为关键营养成分之一,谷氨酰胺(Glutamine, GLN)剥夺或阻断GLN代谢条件下Mφ-EV(EVGLN-)相较于常规添加GLN(EVGLN+)EV的产量显著增加(~4倍)。同时,EVGLN-相较于EVGLN+具有更强的免疫激活潜能,如逆转免疫抑制型M2极化、激活单核细胞的趋化和促进T细胞的活化等。基于多组学分析的进一步机制研究结果显示,GLN剥夺引发M1-Mφ的系统性代谢重编程如能量代谢和氧化还原代谢等,是导致其EV产量和免疫激活作用同时增高的潜在机制。
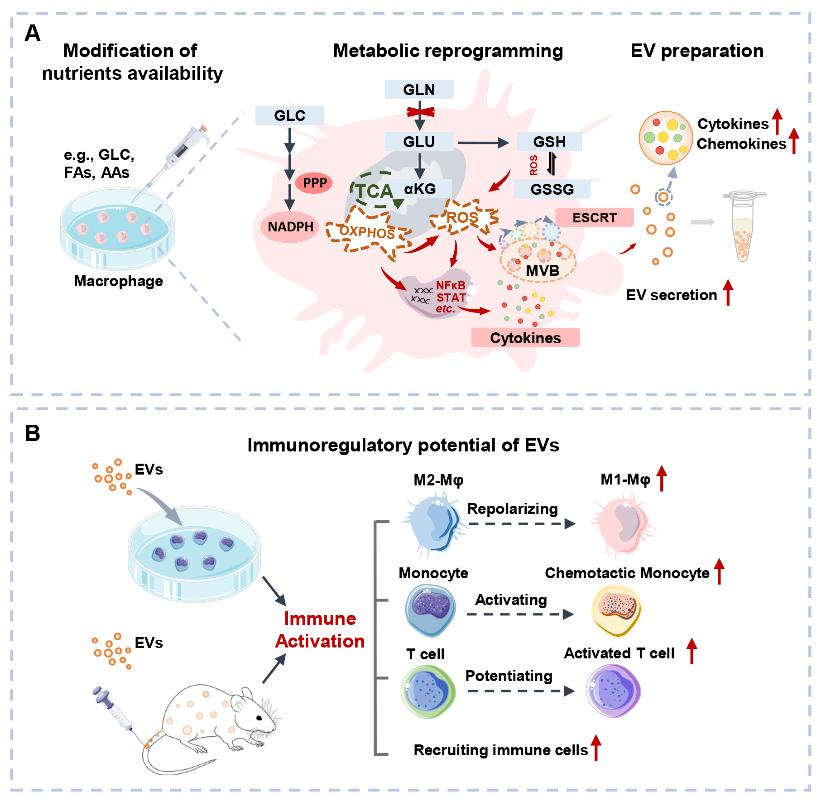
该研究提示,改变培养条件中单一营养组分的可用度足以诱导细胞发生系统代谢重编程,并激活EV产生及其功能分子合成的相关通路,从而实现高效产生具有特定免疫活性的治疗性EV。作为细胞生长不可或缺的物质,调控营养物代谢便于与其它现有工程化EV策略有效结合,以协同增强功能性EV产生,为开发更高效、精准的治疗性EV提供新的策略。
该文通讯作者为国家卫健委移植工程与移植免疫重点实验室刘敬平研究员,第一作者为博士研究生王一卓。我校华西医院为通讯作者和第一作者单位,该研究工作得到了国家自然科学基金、我校华西医院1·3·5计划等项目的资助。
论文链接:https://www.science.org/doi/10.1126/sciadv.adj1290

