近年来,学校坚持科技创新“四个面向”,着力优化“方向—人才—平台—项目—成果”科技创新链,大力营造高质量基础科学研究创新环境,不断增强“从0到1”原始创新能力,加速培育重大基础性原创成果,切实提高学科核心竞争力。2021年学校在生命、医学、化学、物理等多个前沿领域取得重大研究进展,在《Nature》、《Science》、《Cell》发表研究论文7篇。
华西医院生物治疗国家重点实验室苏昭铭研究员课题组在《Nature》发表研究论文首次解析了四膜虫核酶的全长高分辨三维结构,阐明了在底物结合和催化过程中IGS、金属离子、磷酸基团与碱基的构象变化。华西医院生物治疗国家重点实验室杨胜勇教授团队在《Science》发表研究论文首次公开报道了新冠Mpro抑制剂在SARS-CoV-2感染小鼠模型的作用机理和抗病毒效果。华西医院生物治疗国家重点实验室邵振华教授研究组在《Cell》发表研究论文首次解析了多巴胺受体DRD1与G蛋白的复合物结构,在原子层面上详细阐释了DRD1的配体识别、别构调节及与G蛋白偶联的机制。化学学院苏静教授作为共同第一作者在《Nature》发表研究论文,首次合成并表征了一种二茂型锎配合物,对锕系元素锎(Cf)的化学成键和光谱性质进行了深入的理论研究和计算分析。物理学院杨朝文教授、白立新副教授等参与在《Nature》、《Science》发表研究论文,首次探测到能量高达1.4PeV(1PeV=一千万亿电子伏)的γ光子、精确测定了宇宙“标准烛光”蟹状星云的0.3TeV~1.1PeV超高能段伽马能谱。华西临床医学院研究生刘晓珂参与在《Nature》发表研究论文,提出根据结构对表皮生长因子受体(EGFR)突变进行分类可更好地为非小细胞肺癌(NSCLC)患者匹配靶向疗法。
附:我校2021年取得的多项重大基础研究进展
①
首次揭示3.1 Å全长四膜虫核酶冷冻电镜结构
RNA具有重要的生物学功能,很多非编码RNA可以折叠成复杂的三维结构以行使或参与重要的生命过程,如催化、转录和翻译调控等。但由于RNA三维结构信息的匮乏,导致目前对RNA三维结构与功能间关系的认知仍相对有限。冷冻电镜现已成为生物大分子结构解析不可或缺的技术,然而由于RNA结构本身较强的不均一性,纯RNA冷冻电镜高分辨结构的获得依然具有很大的挑战。此前,冷冻电镜数据库中仅有不到10个分辨率优于5 Å的纯RNA结构,最高分辨率是3.7 Å。
四膜虫核酶的核心区域P3-P9具有非常紧凑的三维结构来形成酶催化位点,是研究RNA三维结构与催化功能关系的重要模型。通过单颗粒冷冻电镜技术解析四膜虫核酶的全长高分辨三维结构,阐明了在底物结合和催化过程中IGS、金属离子、磷酸基团与碱基的构象变化,为长达40年来对四膜虫核酶剪接反应的研究提供了结构和机制上的支持,同时也为后续进行高分辨RNA冷冻电镜结构的研究提供了范式(图1)。
图1. 四膜虫核酶holo状态结合底物后进行催化反应。5’ 外显子(黄色)和3’ 外显子(橙色)在核酶的作用下连接形成外显子并最终离开四膜虫核酶。
上述研究成果为华西医院生物治疗国家重点实验室苏昭铭研究员团队,联合美国斯坦福大学Wah Chiu和Rhiju Das团队,共同在Nature杂志上以“Cryo-EM Structures of Full-Length Tetrahymena Ribozyme at 3.1 Å Resolution”发表。原文链接:https://www.nature.com/articles/s41586-021-03803-w。
②
首次公开报道了新冠Mpro抑制剂在SARS-CoV-2感染小鼠模型的作用机理和抗病毒效果
由新型冠状病毒SARS-CoV-2引起的COVID-19大流行持续对全球公共卫生造成严重威胁。截至2021年1月底,该病毒已感染超过1亿人次,并导致220多万人死亡。遗憾的是,至今尚缺乏抗SARS-CoV-2的特效药物。因此针对新冠病毒的创新药物研发迫在眉睫。
SARS-CoV-2主蛋白酶(Mpro)在病毒复制过程中起关键作用,同时其具有不同于人体蛋白酶的特异切割位点,因而被认为是开发抗新冠病毒药物的理想靶标。该研究工作首先设计合成了32个包含双环脯氨酸片段的体外具有效抑制SARS-CoV-2 Mpro活性的全新结构小分子化合物,通过体外细胞水平上的抗SARS-CoV-2病毒活性、大鼠药代动力学性质和安全性等评价,筛选出两个高活性、具有良好药代动力学性质和安全性的小分子化合物(MI-09、MI-30)并开展体内抗病毒活性测试,发现其可显著降低肺部病毒载量和肺部病理损伤(图2)。从分子、细胞和动物三个层面详细阐述了这些抑制剂的作用机理和抗病毒效果,从药代动力学性质和安全性等方面证实该系列化合物具有开发成抗SARS-CoV-2病毒药物的潜力。这是首次公开报道的新冠Mpro抑制剂在SARS-CoV-2感染小鼠模型的实验数据。

图2.对两类小分子化合物(MI-09、MI-30)开展体内抗病毒活性测试
上述研究成果为华西医院生物治疗国家重点实验室杨胜勇教授团队联合中科院昆明动物研究所,在Science上以“SARS-CoV-2 Mpro inhibitors with antiviral activity in a transgenic mouse model”发表。原文链接:https://www.science.org/doi/full/10.1126/science.abf1611。
③
首次解析多巴胺受体DRD1与G蛋白的复合物结构
多巴胺(Dopamine)是一种能够给人带来愉悦感受的神经递质,在中枢神经系统疾病治疗中具有重要作用。多巴胺通过多巴胺受体调节多种生理过程,如奖赏、成瘾、记忆、新陈代谢和激素分泌。多巴胺受体包含D1类受体和D2类受体两个亚家族,其中D1类受体(DRD1和DRD5)通过激活Gs/Golf和刺激环磷酸腺苷(CAMP)的产生,调节中枢神经系统奖赏、运动和认知,并在外周组织中发挥有益的作用。相比之下,D2类受体(DRD2、DRD3和DRD4)与Gi/Go偶联,抑制cAMP积累并调节不同的生理效应。目前为止,D2类受体识别拮抗剂配体的分子机制,选择性激动剂Bromocriptine激活DRD2-Gi信号转导复合物的分子机制相继被揭示。然而,D1类亚家族识别配体的结构基础仍然缺乏,高选择性激动剂药物是治疗帕金森病以及肾损伤高血压的临床需求。D1类多巴胺受体的结构基础将为选择性激动剂开发提供理论依据。
该研究采用冷冻电镜技术首次解析了DRD1-Gs复合体分别结合儿茶酚类(Catechol like)激动剂(降血压药Fenoldopam、完全激动剂A77636和G蛋白偏向性激动剂SKF83959)、非儿茶酚类(Non-catechol like)激动剂PW0464,以及同时结合快乐荷尔蒙Dopamine和正向别构调节剂LY3154207的三维结构(图3)。通过利用单颗粒冷冻电镜技术解析了多巴胺受体DRD1与G蛋白的复合物结构,从而在原子层面上详细阐释了DRD1的配体识别、别构调节及与G蛋白偶联的机制,该项研究将为高血压、帕金森综合症、肾损伤等疾病的药物开发和治疗带来新的曙光。
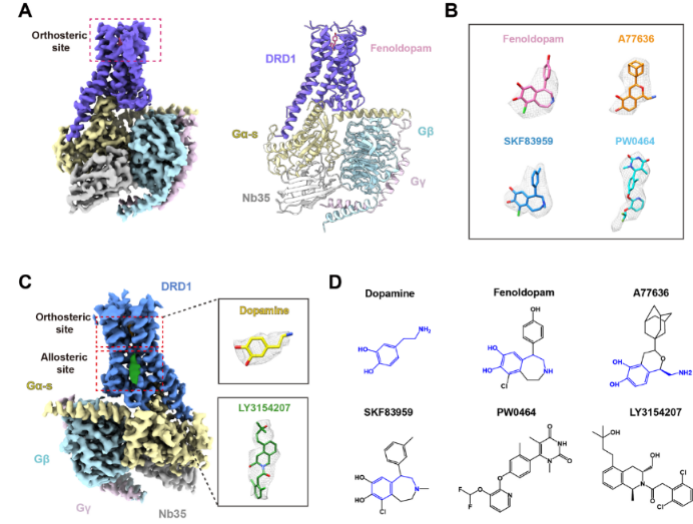
图3. DRD1-Gs与不同配体的冷冻电镜三维结构
上述研究成果为华西医院邵振华教授研究团队,联合山东大学于晓-孙金鹏教授团队,西安交通大学张磊教授团队以及香港中文大学(深圳)杜洋教授,共同在Cell上以“Ligand recognition and allosteric regulation of DRD1-Gs signaling complexes”发表,原文链接:https://www.sciencedirect.com/science/article/pii/S0092867421000714。
④
首次合成并表征了一种二茂型锎配合物
锎(Cf)是目前微克级别上制得的最重元素。Cf同位素的稀缺性和严重的放射性危害使得相关实验研究极具挑战性。因此,与其他f元素相比,Cf的5f/6d价轨道参与化学成键的能力、自旋-轨道耦合在电子结构中的作用以及反应类型等一系列化学性质仍处于未知状态。金属有机化合物对解释金属元素的周期性和成键趋势有重要作用。近年来,研究人员对锕系元素钍(Th)至钚(Pu)以及镅(Am)的金属有机化学性质进行了探索,但鲜有关于锔(Cm)至锎(Cf)的研究报道。
该研究首次合成并表征了一种二茂型锎配合物[Cf(C5Me4H)2Cl2K(OEt2)]n(图4),特别是对Cf元素的化学成键和光谱性质进行了深入的理论研究和计算分析。采用高精度从头算多参考理论方法CASSCF/NEVPT2并包括自旋-轨道耦合效应,精确模拟了锎化合物的UV-vis-NIR光谱,理论预测的光谱特征与实验结果高度一致(图5)。同时利用含时密度泛函理论(TDDFT)计算和分子轨道能级分析很好地解释了深橙色化合物[Cf(C5Me4H)2Cl2K(OEt2)]n与无色化合物[Dy(C5Me4H)2Cl2K(OEt2)]n在颜色方面的差异性。该研究为阐释镧锕体系复杂的电子结构和化学成键性质,特别是精确解析实验光谱提供了有力支撑和科学指证。
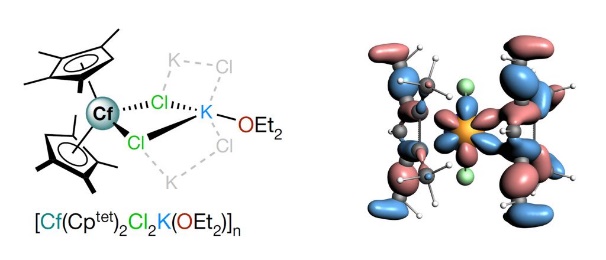
图4. [Cf(C5Me4H)2Cl2K(OEt2)]n的几何结构以及含Cf 5f成分的成键轨道
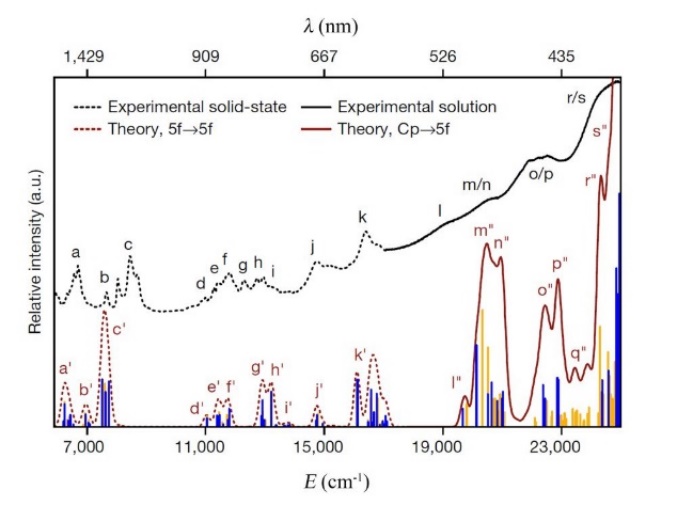
图5.实验观测与理论模拟的[Cf(C5Me4H)2Cl2K(OEt2)]n化合物的UV-vis-NIR光谱
上述研究成果为化学学院苏静教授课题组,联合美国洛斯阿拉莫斯国家实验室锕系化学实验和理论研究团队,以共同第一作者在Nature上以“Isolation and characterization of a californium metallocene”发表。原文链接:https://www.nature.com/articles/s41586-021-04027-8?utm_source。
⑤
开启“超高能伽马天文学”时代
宇宙中弥漫着相对论性的带电粒子,人们把这些粒子称为“宇宙线”。然而探测宇宙线的加速源并非易事,最主要的一个问题在于宇宙中无处不在的磁场会使得宇宙线的运动方向发生偏折。已知宇宙射线在其加速器附近会产生γ射线,或许寻找这种高能γ射线可以为寻找这些神秘的PeVatron指明方向。探索高能宇宙线起源以及相关的宇宙演化、高能天体演化和暗物质的研究是全世界都在关注的世纪之谜。
最近,国家重大科技基础设施项目“高海拔宇宙线观测站”(LHAASO)宣布在世界上首次精确测定了来自蟹状星云的0.3TeV~1.1PeV超高能段的伽马能谱,此将成为目前该能段“标准烛光”的唯一标准(图6)。LHAASO合作组同时期另一研究表明,在银河系内发现大量超高能宇宙加速器,并记录到最高1.4拍电子伏伽马光子(拍=千万亿),这是人类观测到的最高能量光子,改变了人类对银河系的传统认知,开启“超高能伽马天文学”时代(图7)。
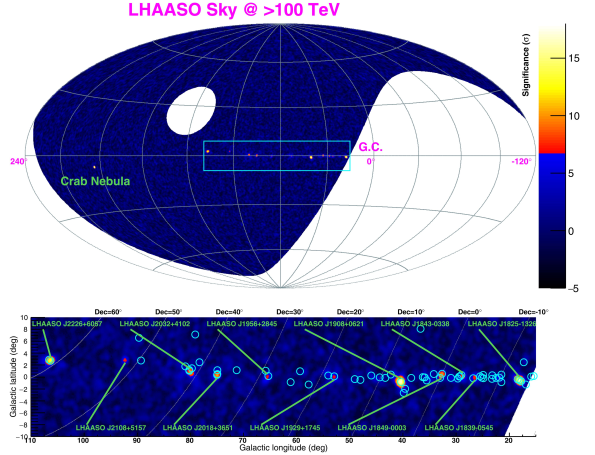
图6. LHAASO观测到的12个超高能量γ射线源信息列表及位置示意图

图7. LHAASO及其它实验观测到的蟹状星云伽马能谱
上述研究成果为物理学院辐射探测与核电子学课题组杨朝文教授、白立新副教授等参与,通过LHAASO合作组分别在Science上以“PeV gamma-ray emission from the Crab Nebula”、在Natures上以“Ultrahigh-energy photons up to 1.4 petaelectronvolts from 12 γ-ray Galactic sources”发表。原文链接:https://www.science.org/doi/10.1126/science.abg5137;https://www.nature.com/articles/s41586-021-03498-z?utm_source。
⑥
对EGFR突变进行结构分类为非小细胞肺癌匹配靶向疗法
皮生长因子受体(EGFR)是一种细胞表面酪氨酸激酶受体,其突变通常发生在外显子中,并且是非小细胞肺癌(NSCLC)中已建立的驱动程序突变。靶向治疗被批准用于具有“经典”突变和少量其他突变的患者。但是,尚未确定其他EGFR突变的有效疗法。此外,非典型EGFR突变对药物敏感性的频率和影响尚不清楚。因此,需建立一种基于结构功能分类的方法来预测EGFR突变NSCLC的药物敏感性反应,从而获得针对不同突变的癌基因进行靶向治疗和临床试验的机会。
针对这一问题,美国德克萨斯大学MD安德森癌症中心Heymach团队分析了来自五个不同据库的11619名EGFR突变NSCLC患者的突变情况,发现无论使用何种类型的TKI,非典型突变患者的治疗失败的时间(time to treatment failure,TTF)明显短于经典突变患者。随后,研究人员创建了76个具有EGFR突变的细胞系,对比18种EGFR 抑制剂对其进行筛选,观察到四个不同的EGFR突变亚群(图8)。通过计算每个突变的药物敏感性、分类、回归树(CART)分析,进一步验证了这种基于结构的亚群方法的有效性。按照结构和功能对表皮生长因子受体(EGFR)突变进行分类,可预测EGFR突变型NSCLC的药物反应,为患者匹配合适的靶向药物提供了一个更精准的框架,或将迎来精准治疗时代。
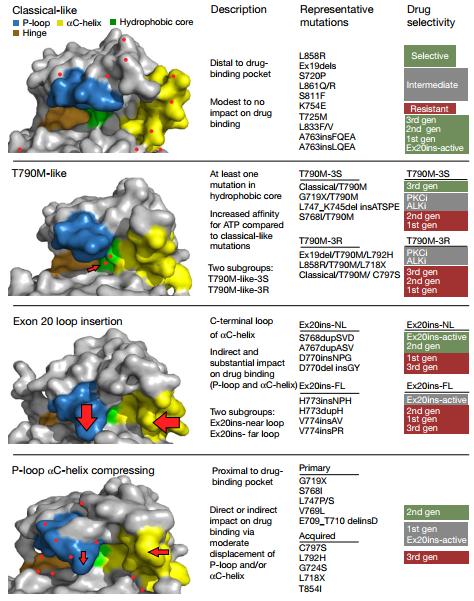
图8. EGFR突变的四个不同的亚组
上述研究成果为华西临床医学院研究生刘晓珂参与,美国德克萨斯大学MD安德森癌症中心胸科/头颈肿瘤内科John V. Heymach课题组在Nature上以“Structure-based classification predicts drug response in EGFR-mutant NSCLC”发表。原文链接:https://www.nature.com/articles/s41586-021-03898-1?utm_source。

