精子发生是一个高度复杂的生物学过程,涉及精原细胞的增殖分化、减数分裂和精子细胞变形等过程。这一过程需要精确的基因表达调控,尤其是在精子变形期,由于染色质高度浓缩,转录活动逐渐停止,翻译后调控在这一阶段显得尤为重要。近年来,液-液相分离(LLPS)介导的生物分子凝聚体在调控细胞功能方面的作用引起了广泛关注。而在精子变形过程中,一个非常显著的事件是近端中心粒与远端中心粒的迁移与形成,其在精子发生与精子中心体形成中均具有关键作用,目前已鉴定出超过30多种的CEP蛋白,但其在精子变形与受精等过程中的作用尚未完全阐明。

近日,四川大学华西第二医院生殖遗传与表观遗传实验室许文明团队和中信湘雅生殖与遗传专科医院谭跃球团队合作在Nature Communications上发表了题为CEP112 Coordinates Translational Regulation of Essential Fertility Genes During Spermiogenesis Through Phase Separation in Humans and Mice的研究论文。这项研究揭示了中心体蛋白112(CEP112)在精子形成过程中的关键作用,并为男性不育的分子机制提供了新的见解。
研究团队首先通过全外显子组测序在两例少弱畸形精子症患者中发现了CEP112基因的双等位基因变异。为深入了解CEP112的功能,研究人员构建了CEP112基因敲除小鼠模型。实验结果显示,CEP112缺失导致雄性小鼠不育,表现为精子数量减少、活力下降和形态异常。研究人员发现CEP112在成熟精子定位于精子的颈部和非典型中心粒,并在精子发育过程中形成RNA颗粒,富集了如Fsip2、Cfap61和Cfap74等调控精子发生的关键mRNA。通过多组学分析和实验验证,研究团队证明了CEP112调控目标mRNA的翻译。通过免疫共沉淀和质谱分析,他们确定了CEP112与翻译相关蛋白的相互作用,包括hnRNPA2B1、EEF1A1和EIF4A1。此外,FRAP与体外生化实验证实CEP112与hnRNPA2B1能够在体外发生液-液相分离,形成凝聚体并招募重要的翻译因子和其调控的mRNA。值得注意的是,患者来源的CEP112突变体显示出相分离能力的降低和翻译效率的下降,为理解CEP112突变导致不育的分子机制提供了线索。这些结果表明CEP112通过液-液相分离介导RNA颗粒的组装,从而控制男性生育关键基因的转录后表达。
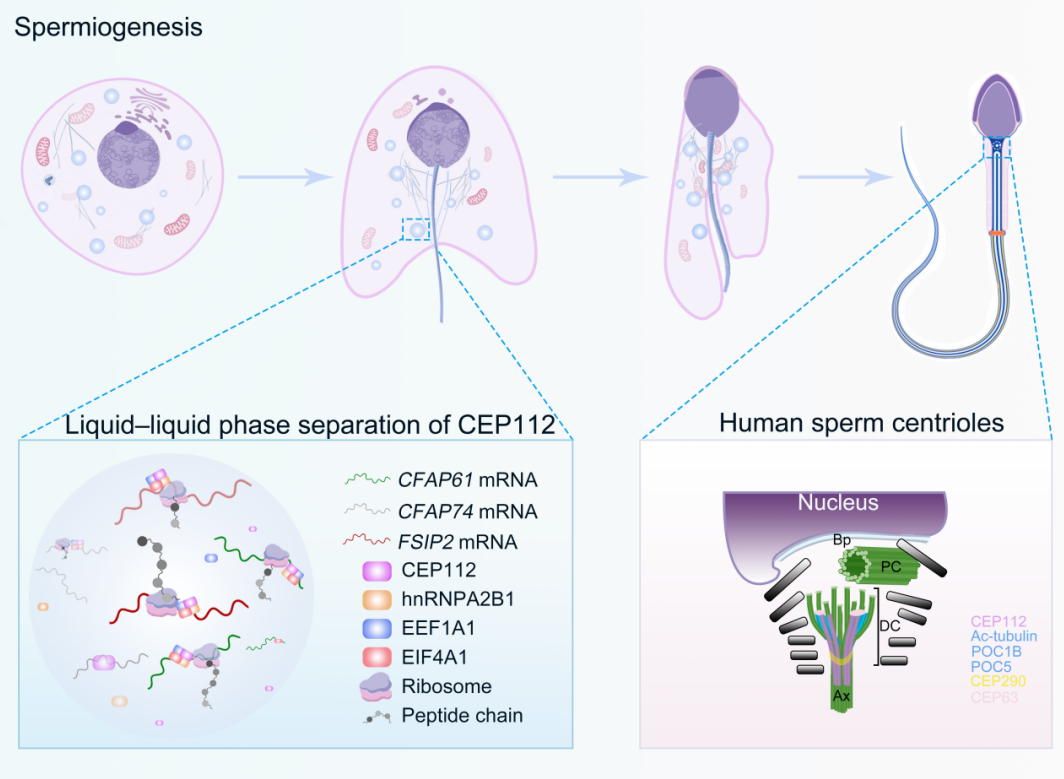
本研究深入阐释了CEP112在精子发生中的关键角色,并拓展了我们对生物分子凝聚体调控生殖细胞功能的认识。继刘默芳团队2022年在Science发表FXR1通过相分离调控精子发生中mRNA翻译的研究之后,当前工作进一步突显了中心体蛋白可通过与精子鞭毛发育过程中的关键RNA结合,并通过液-液相分离机制发挥作用,为生殖生物学中相分离现象的理解奠定了基础。同时与临床相关的分析也发现,尽管CEP112的KO小鼠的ICSI的发育结局正常,CEP112基因突变患者在接受ICSI治疗后,出现胚胎发育停滞和种植失败。这一现象揭示了中心粒在小鼠和人类精子功能中的显著差异,表明其作用并非在物种间完全保守。研究结果强调了人类CEP蛋白在男性因素相关的早期胚胎发育中的关键作用。因此对CEP相关基因突变的分析对于临床靶向检测和干预策略的制定具有重要意义。这些成果不仅为男性不育症的诊疗提供了新思路,也为针对男性不育的调控相分离过程的药物设计与RNA治疗策略设计均提供了可能的分子靶点与治疗思路。
四川大学华西第二医院博士研究生张学广、黄格琳、蒋婷、李童童与中信湘雅生殖与遗传专科医院的蒙岚岚为论文的共同第一作者。此外,中国科学院动物研究所王震波教授、厦门大学纪志梁教授及四川大学华西第二医院的邓东教授在本研究中做出了重要贡献。
原文链接:https://doi.org/10.1038/s41467-024-52705-8

