变构配体在调节蛋白质功能中可以提供更高的选择性和特异性,降低脱靶副作用,因此为现代药物设计提供了一条新途径。然而,变构位点通常是隐藏在特定的构象态中,复杂的构象变化导致了实验对变构位点识别的困难性,限制了变构药物的研发。尽管分子动力学(MD)模拟提供了一个有效的途径来捕捉这些微观构象随时间的变化情况,但如何从MD产生的庞大构象空间中识别出位点打开的构象却是一个困难的技术挑战。
近日蒲雪梅教授团队从变构机制的残基构象变化的本质出发,结合机器学习和MD创新性地开发了一个能够从高维复杂的MD构象空间中挖掘关键构象并识别出变构位点的杂化机器学习方法(RHML),成功识别出β2AR受体的一个全新变构位点及负变构调剂,并通过阐明其调节机制进一步给出了其变构作用的理论依据。基于这些充足的计算证据,邵振华教授团队完成了cAMP累积实验以及定点突变实验,实验结果和计算完全一致,确认了变构位点和所筛选配体的负变构效应。该研究工作所开发的识别方法为众多的靶标蛋白家族变构位点和药物识别提供了一个新的智能分析工具,有助于推进变构药物的开发。此外,研究结果为β2AR变构药物的研发提供了一个全新的变构位点,所识别出的ZINC5042是首个报道的β2AR的G蛋白偏向的负变构调节剂,可为治疗充血性心力衰竭(CHF)所需的 β-blocker的研发提供了一个潜力的候选物。
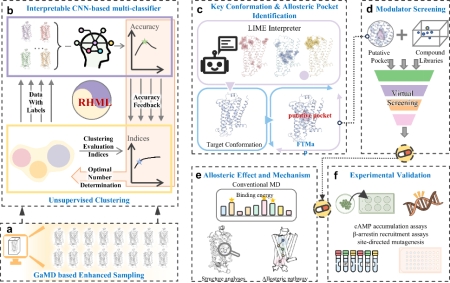
图1. 变构位点及变构调节剂识别框架
该研究以“Integrative residue-intuitive machine learning and MD Approach to Unveil Allosteric Site and Mechanism for β2AR”为题发表在Nature Communications,四川大学化学学院为第一通讯单位,文章第一作者为四川大学化学学院博士研究生陈欣、陈建芳以及四川大学华西医院博士研究生王可欣,四川大学化学学院蒲雪梅教授和四川大学华西医院邵振华教授为本文共同通讯作者。特别感谢国家自然科学基金、四川省国际科技创新合作项目、天府锦城实验室(前沿医学中心)基金对课题的支持。
原文链接:https://www.nature.com/articles/s41467-024-52399-y

