器官纤维化是多种疾病的主要病理学特征,而全球疾病死因约有三分之一归于纤维化。肺纤维化导致患者呼吸衰竭和死亡,平均生存周期低于肺癌。现有药物无法有效逆转纤维化进程。促进纤维化肺组织再生可望恢复受损的肺泡和血管结构,为包括肺纤维化在内的多种疾病治疗提供策略。因此发掘肺修复中促再生并抑制纤维化治疗靶点具有临床价值。
丁楅森团队以往工作发现血管内皮细胞通过旁分泌Angiocrine因子与邻近的上皮、间质及血液细胞互作从而调控肺的再生和纤维化(文献1-6)。近日,四川大学生命科学学院丁楅森团队在Cell Metabolism发表题为“Dopaminylation of endothelial TPI1 suppresses ferroptotic angiocrine signals to promote lung regeneration over fibrosis”的研究论文。该研究通过整合点击化学、蛋白组学、结构生物学、基因敲除/敲入鼠、临床分析等多学科手段,发现多巴胺通过修饰肺血管TPI1调控Angiocrine因子,抑制铁死亡从而促进肺再生并抑制纤维化。

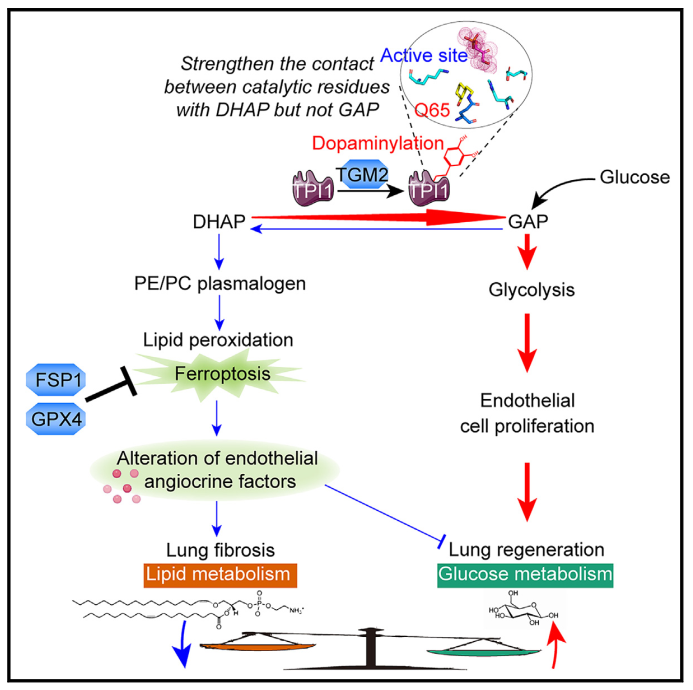
蛋白修饰作为分子开关,可迅速调节细胞状态,包括调控内皮细胞增殖等。单胺类神经递质,如多巴胺、五羟色胺、去甲肾上腺素和组胺,可以通过TGM2酶活性共价修饰蛋白质。该研究首先利用小鼠肺再生模型、单细胞测序(scRNA-seq)、血管内皮特异性敲除TGM2(Tgm2i∆EC/i∆EC)以及特异性敲入铁死亡抑制因子GPX4(Gpx4EC KI)和FSP1(Fsp1EC GOF)小鼠,发现TGM2依赖的多巴胺化修饰通过抑制血管内皮铁死亡促进肺的再生。为了在血管内皮细胞中鉴定多巴胺化修饰的靶蛋白,整合了化学蛋白质组学和点击化学技术发现内皮细胞TPI1是主要的多巴胺化修饰蛋白。然后利用体外筛选、体内模型以及内皮特异性基因敲除/敲入鼠,证明了TPI1作为TGM2介导的多巴胺化修饰靶点,在肺再生过程中抑制内皮细胞铁死亡。
TPI1是一种代谢酶,可以催化醚磷脂合成前体DHAP与葡萄糖关键代谢物GAP之间的相互转化。作者们进一步通过质谱分析,发现TPI1多巴胺化修饰发生在其Q65氨基酸位点。通过蛋白结构分析,TPI1 Q65位点的多巴胺化修饰增强了其催化残基与DHAP之间的接触,引导酶促反应朝着将DHAP转化为GAP的方向进行。
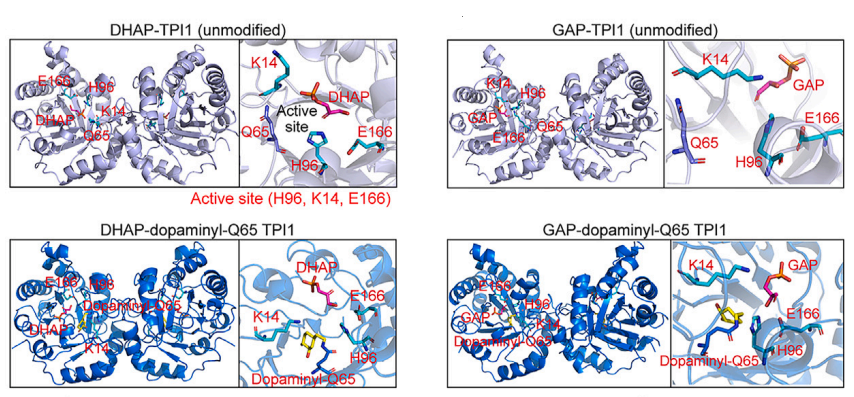
血管内皮细胞通过旁分泌Angiocrine因子形成“引导性血管微环境”,调控肺再生和纤维化。利用肺再生模型和肺组织精细切片(PCLS),发现在再生肺内皮细胞中阻断TPI1多巴胺化会诱发铁死亡,重编程血管微环境旁分泌因子信号。这种受损的血管内皮旁分泌功能促进了成纤维细胞的活化,并减少了肺泡上皮细胞的再生。
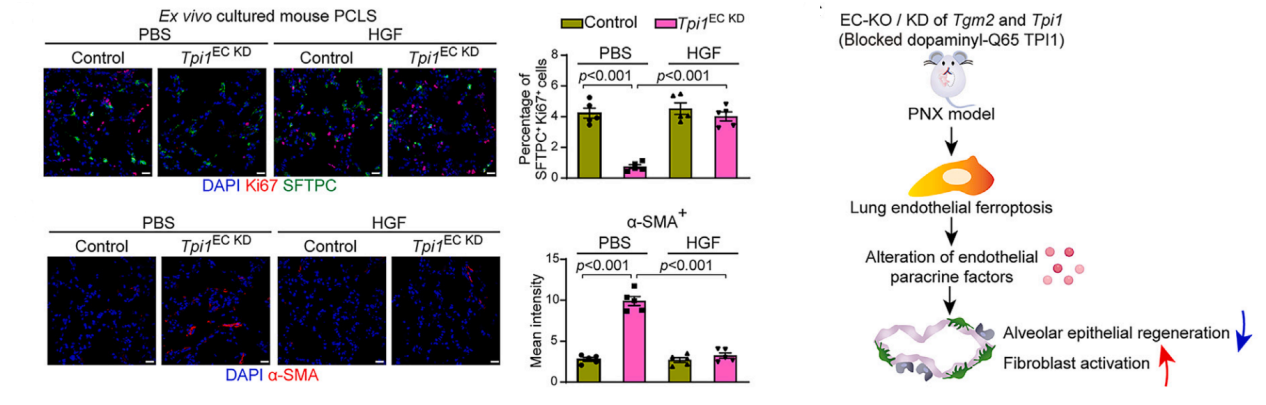
因为在肺再生过程中阻断内皮TPI1多巴胺化修饰会促进成纤维细胞活化,进而直接探究TPI1多巴胺化修饰在肺纤维化患者和肺纤维化小鼠模型中的作用。研究发现在人和小鼠纤维化肺内皮细胞中,TPI1多巴胺化修饰的水平显著降低。进一步利用血管内皮特异性FSP1表达小鼠,发现TPI1多巴胺化修饰可以抑制肺内皮细胞铁死亡,从而缓解肺纤维化。最后,通过小分子药物恢复内皮TPI1多巴胺化修饰水平,能够抑制内皮细胞铁死亡并下调促纤维化旁分泌因子,减轻肺纤维化。
综上,该研究发现了肺血管微环境靶点TPI1的多巴胺化修饰在肺再生中平衡了内皮脂质/葡萄糖代谢,并抑制了促纤维化的铁死亡,从而维持促再生的Angiocrine功能,并抑制肺纤维化。所揭示的Angiocrine调控机制可为器官纤维化的再生疗法提供靶点,开发靶向血管微环境药物。
四川大学莫春横博士及研究生黎慧、闫孟利、许诗雨、吴锦焰、李家晨和杨昕淳为论文的共同第一作者。四川大学丁楅森为最后通讯作者,四川大学生命科学学院为第一单位。
论文链接:https://doi.org/10.1016/j.cmet.2024.07.008

